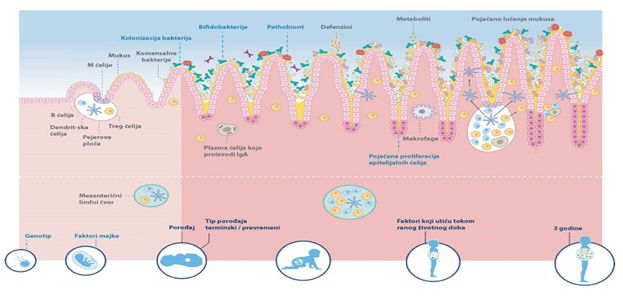
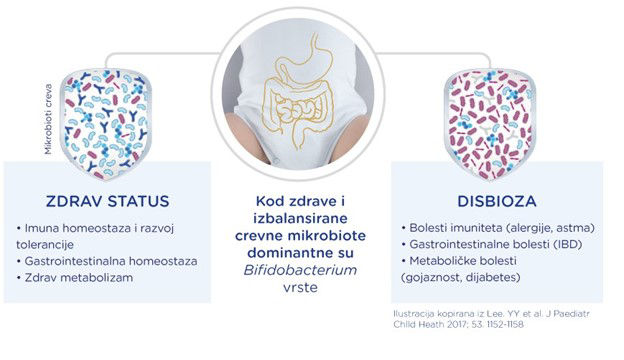
1.Wopereis H, et al. Pediatr Allergy Immunol 2014;25:428-438. 2. Vandenplas et al. Nutr. 2020; 78:110812 3. Petersen C and Round L. Cellular Microbiology 2014;16(7):1024–33. 4. Danone Nutricia Research. (2018) „Compromised Gut Microbiota at Birth“ Available from: https://www.nutriciaresearch.com/compromised-gut-microbiota-at-birth/ 5.Wemmer U. (1977 Feb 17) Meb Fortschr Med; 95(7):441-6. 6. Van ‘t Land et al. (2010) In: Watson, R.R., Zibadi, S. and Preedy, V.R. (eds.) Dietary components and immune function. Springer, Berlin, Germany, pp. 25-41. 7. Furness JB, et al. Am J Physiol. 1999;277(5):G922-G928. 8. Kumar H et al. Microorganisms, 2020;8(12). 9. Underwood M et al. Pediatr Res, 2015;77(1–2):229–35. 10. Shaterian N et al. Open Medicine, 2021;16:624–39. 11. Martin et al. (2009) Applied and environmental microbiology, 75(4), 965-969. 12. Hunt et al. (2011). Plos ONE: 21313. 13. Tsilingiri et al. (2013). Benef Microbes 1;4(1):101-7. 14. Thurl S, et al. Nutr Rev, 2017;75(11):920-33. 15. Coppa GV, Int. Conf. on Breast milk and Lactation 1991 USA. 16. Bode L, et al. Thromb Haemost, 2004;92(6):1402-10. 17. Eiwegger T, et al. Pediatr Allergy Immunol, 2010;21(8):1179-88. 18. Boehm G, et al. In: Mattia-Sandholm T(ed): Funct. Diary prod. Woodhead Publ Ltd, 2002.
19. Newburg D, et al. Glycobiology, 2004;14(3):253-63. 20. Boehm et al. (2002) Archives of Disease in Childhood-Fetal and Neonatal Edition, 86(3), F178-F181. 21. Bennet et al. (1992) Acta Paediatrica, 81(10), 784-787. 22. Wang S, et al. Neuroscience and biobehavioral reviews. 2018. 23. Meulenbroek et al. (2013) Pediatric Allergy and Immunology, 24(7), 656-664. 24. Van der Aa LB et
al. (2010) Clinical & Experimental Allergy. 40(5):795-804. 25. Salminen S et al., Nutrients, 2020. 12(7):1952.
26. Taniuchi S al. (2005) Journal of Applied Research in Clinical and Experimental Therapeutics. 5(2):387